原子量是什么意思(化学世界-从最软到最硬物质)
著名的法国化学家莫瓦桑应用电镀方法,首次制取了活泼而毒性很大的氟;发明了高温电炉,熔炼了钨、钛、钼、钒等高熔点金属,在世界享有盛誉。19世纪90年代,他开始了另一个梦想“点石成金”——把石墨转化成金刚石。

为了实现梦想,莫瓦桑和他的团队开始了漫长的“炼石之旅”。他试着先制取氟碳化合物,然后除去其中的氟以制取金刚石,但几经试验,都没有成功。怎么办?
经过反复构想,他设计出一个完美的方案,然后一次又一次地按这个方案做试验:利用自己发明的高温电炉,把铁熔融成铁水;然后把炭投入这高温铁水中;再把这铁水倒入冷水中,借助铁的急剧冷却收缩时所产生的压力,迫使其中的碳原子重新排列成大晶体;最后用稀酸溶解掉铁,这样就可得到金刚石晶体了……1893年2月6日,莫瓦桑的“梦想”终于实现了:当他和助手用酸溶去铁后,在石墨残留物中,有一颗0.7毫米的晶体在闪闪发光!
这颗晶体是金刚石吗?
莫瓦桑是世界人造金刚石第一人吗?

1 炭碳有别

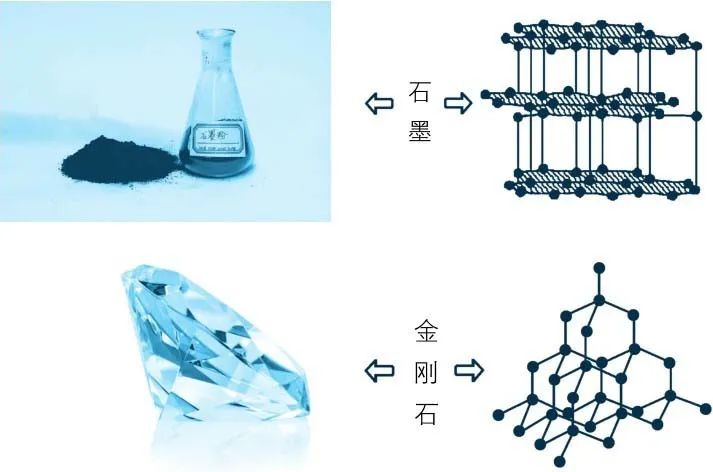
石墨与金刚石中的原子排列
在我们生活中,经常会听到“碳”这个字和一些由它组成的词语,但很多人常常把“炭”和“碳”混淆。譬如我们常说的能燃烧的“木炭”,烧完以后剩下的“炭灰”,以及非常重要的能源“煤炭”等,其中的“炭”说的是一种宏观物质。而现在要提到的“碳”,是一种原子量(即相对原子质量,下同)为12的化学元素的名称,元素符号为C,在元素周期表中排在第六位,它是构成上述各种“炭”材料的元素。换句话说,那些生活中的“炭”是“碳”的一种单质,所以它们理所当然属于碳家族的成员。
碳家族的成员当然不止这些燃烧后供人类获取能量的材料,还有很多平时不为燃烧而用的物质(尽管它们在一定条件下也能燃烧),比如朴实无华的石墨(铅笔芯的主要成分),光彩耀人的钻石。
表面上相差很大的这两种东西,居然是同宗同族的兄弟?不要奇怪,这是千真万确的事实,它们都是碳的不同形式的单质。因为钻石价值连城,而石墨却很常见,所以就如开头所述,很早以前,科学家就尝试将石墨转化成钻石。但这个过程非常复杂,直到科技高度发达后才能成功。

金刚石璀璨夺目,是地球上最硬的物质,石墨是最软的矿物之一。为什么同一种元素组成的单质会有如此大相径庭的外貌和性质?这得从物质的组成和结构说起。
我们知道,有的物质是由原子所组成的分子构成的,比如水是由2个氢原子与一个氧原子组成的水分子构成的;有的物质则是直接由原子构成的,比如金就是由金原子按照一定的排列方式构成的。碳家族的单质属于直接由碳原子构成的一类物质。这些碳原子以何种方式排列,以怎样的结构存在,各原子之间的相互位置关系和作用状态如何,就决定了最后所得物质的种类和状态。
2 石墨和金刚石

石墨和金刚石中碳原子的排列都非常有序,不过各有不同。我们知道,碳原子最外层有4个电子,而一般原子只有在最外层有8个电子的时候才是最稳定的,因此,单独的碳原子是不稳定的。一个碳原子必须与最邻近的其他4个碳原子形成共价键,才能达到8电子的稳定状态,也就是说每个碳原子(我们称之为中心碳原子)周围应该有4个最邻近的碳原子。那么,这4个碳原子位于中心碳原子的什么方位呢?

从石墨到金刚石
怎样才能让石墨转化为金刚石呢?使石墨转变为金刚石,不仅仅是用外力缩短石墨层与层之间的距离,使六角形碳环转变为正四面体晶格,实际上还包含许多复杂因素。化学家借助热力学作出判断,在常温条件下实现这个转化,需要的压强为1.3×109帕;如果升高温度,如达到650℃,需要的压强至少为4.0×109帕。从实验条件方面来说,必须有能够产生高压的装置和耐高温、耐高压的设备。1954年,在温度为1650℃、压强为9.5×109帕的条件下,美国GE公司的科学家第一次成功合成了人造金刚石,揭开了人造金刚石工业的新篇章。

在金刚石中,这4个周边碳原子对称分布在中心碳原子的周围,就好像一个正四面体,这是一种高度有序和对称的排列。一般由微粒有序排列起来的固体我们称之为晶体,金刚石就是碳的最完美晶体。金刚石中的碳原子形成共价键时的距离非常近(大约为0.154纳米,和一个碳原子的大小差不多),之间的作用力非常强,这就是我们很难用物理方法将一颗钻石粉碎和瓦解的原因。当然,构成如此完美无瑕的排列结构需要大自然的特殊眷顾,天然钻石非常少,所以极其珍贵。

那石墨中碳原子的排列又有什么不同呢?石墨中每个碳原子周围只有3个最邻近的碳原子与它形成共价键,这3个周边碳原子与中心碳原子位于同一个平面上,对称地分布在中心碳原子周围,形成正三角形,然后在同一平面上展开形成了蜂巢式的多个六边形。以六边形所在的平面为一层,石墨便由这种一层层的层状结构堆砌而成。每个碳原子有4个电子,但只形成了3个共价键,那么剩下的一个电子呢?原来,剩余的电子就在这些层与层之间自由地移动,这也就是石墨导电而金刚石不导电的原因。
严格来讲,石墨只能在沿着层面的方向上导电,而在垂直于层面的方向上是绝缘的。每层内以共价键结合的碳原子之间的距离也很小,大约为0.142纳米,因此它们之间也是牢不可破的。层与层之间的距离则要大得多,大概有0.340纳米,而且没有强大的共价键作用,因此石墨在沿着层面方向比较容易碎裂。不过,和金刚石一样,石墨中的碳原子排列也是高度有序的,因此石墨也是一种碳的晶体。
现在回到开头的故事,莫瓦桑真的炼出了金刚石?石墨转化为金刚石的过程如此简单吗?答案当然是否定的。原来,莫瓦桑一次又一次地和助手们重复试验,有一个助手厌烦了,事先偷偷地把一颗金刚石放在铁水里,造成了试验成功的假象。莫瓦桑因为人工合成金刚石而再一次声名鹊起,赢得无数荣誉。而这件假案,直到50年后才真正大白于天下。

法国化学家莫瓦桑逝世100周年纪念邮票。莫瓦桑因制取单质氟而荣获1906年诺贝尔化学奖
3 富勒烯——碳家族中耀眼的明星

随着人类科学水平的发展,碳家族增添了越来越多的新的成员,富勒烯便是其中一颗耀眼的明星。
继石墨、金刚石和无定形碳之后,富勒烯是人们发现的第四种碳的同素异形体。富勒烯存在的第一个光谱证据是在1984年由美国新泽西州的艾克森实室发现的。就在这一年,英国萨塞克斯大学的谱学家克罗托正为自己的研究寻找相应的仪,他在赴美国参加的学术会议上认识了美国莱大学的科尔和斯莫利,后两人设计的仪器让克托眼前一亮。这次偶然的相遇促成了3人的作,他们用高功率激光轰击石墨将其汽化,发并确信C60和C70是两种相当稳定的原子簇分子,接下来他们努力想搞清楚这两个碳家族新成员的结构。

1996年诺贝尔化学奖得主克罗托

富勒烯因构型很像建筑学家富勒设计的加拿大蒙特利尔世界博览会会馆球形圆顶薄壳而得名
和石墨及金刚石中巨大的碳原子数目不同,富勒烯中有限的碳原子数决定了它只可能是一个个较小的相对独立的结构。这时候他们想到了一个人——富勒,这位建筑师设计了加拿大蒙特利尔世界博览会会馆的球形圆顶薄壳,利用正五边形和正六边形拼接而成的顶部近似于球面。他们觉得C60分子很有可能是一种类似于富勒设计的圆顶薄壳的球形多面体。在此启发下,克罗托等3人用12个五边形、20个六边形拼出了一个中空的32面体,这就是现在我们所熟知的富勒烯的结构。在每个富勒烯分子中,五边形互不邻接,而是与5个六边形相接,每个六边形又与3个六边形和3个五边形间隔相接,这样共有60个顶角,碳原子位于每个顶角上。
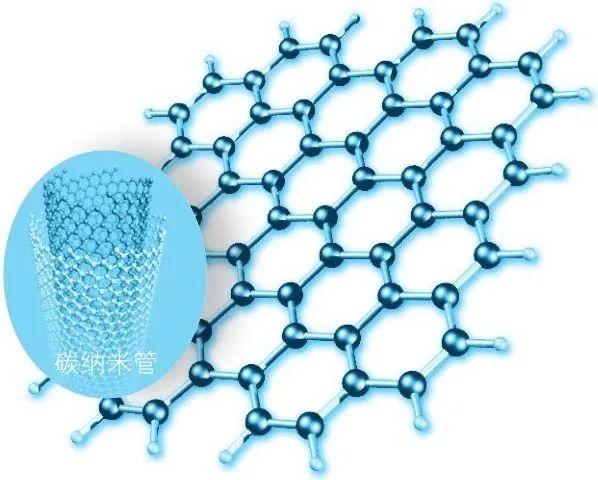
石墨烯晶体
一个多么完美对称的分子!碳家族的第四位成员终于正式浮出水面。为了表示感谢和敬意,克罗托3人用富勒的名字命名他们的新发现(也叫巴基球,来自于富勒的名字)。由于长得极像足球,富勒烯也被叫做足球烯。而克罗托3人也因该项成就分享了1996年的诺贝尔化学奖。
自此以后,有关富勒烯的各项研究工作如火如荼地展开了。1989年,人们实验证实了富勒烯的结构,其他碳原子数(如C28、C32、C240、C540)和非常规碳原子数(如C78、C82、C84、C90、C96)的富勒烯也相继被各个实验室制备出来,现在的科学家们已经能得到外接或者内嵌其他原子的富勒烯。1992年,人们甚至在自然界中也发现了这种之前被认为只能在实验室的苛刻条件下,或者在星际尘埃中才存在的高度对称的完美的分子。
后来,碳家族又陆续增添了一些新成员,如碳纳米管、石墨烯等,它们和金刚石一样,表现出非常独特而优异的性能。而新发现的另外一些新成员,比如蓝丝黛尔石、蜡石、汞黝矿结构等,它们大多来自于陨石和外太空,在地球上不怎么常见。
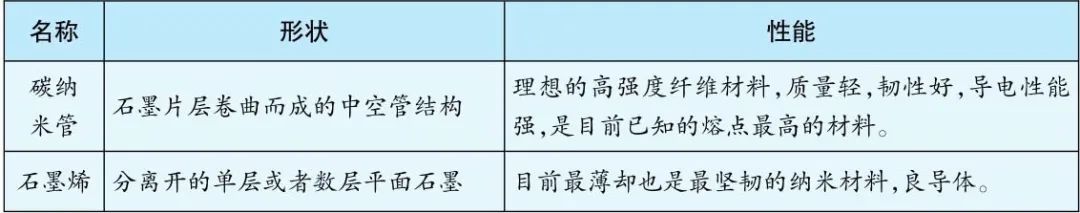
碳家族的新成员
4 不同凡响的碳14

见过达·芬奇名作《最后的晚餐》的人都知道,这幅名画描绘的是基督耶稣被自己的门徒犹大出卖,被钉死在十字架上之前享用最后晚餐的情形。公元33年左右,耶稣被钉死在十字架上后,被一个叫约瑟的好心人取下,约瑟用细麻布将耶稣的尸体裹好放在石头坟墓里。3天之后,耶稣复活逃走,将那块裹尸布留在了墓穴中。这块裹尸细麻布后来下落不明,被基督徒视为圣物。直到1355年它被一位法国骑士带到了公众视野,据称这件圣物是十字军东征君士坦丁堡时得到的。1578年,裹尸布被送到现在的意大利,作为罗马天主教的圣物之一保存在特意为它修建的都灵大教堂内。
碳14的故事就和这块裹尸布有关。在科技不太发达的那个年代,人们没有任何技术手段来探究这块裹尸布的真伪,于是这件圣物也就理所当然地被人们认可并膜拜。但在1988年,这块裹尸布的真实性却遭到了质疑,质疑的有力证据就来自于碳14年代检测法。
达·芬奇名作《最后的晚餐》
碳14含有6个质子和8个中子,原子量为14,它是一种具有放射性的原子,每时每刻总有一些碳原子会放射出射线并变成其他原子。科学家发现了一个有趣的规律,就是每隔大约5730年,原有的碳14原子数量就会减少一半。放射性物质蜕变后,使原有数量减少一半所需的时间,称为“半衰期”,因此碳14的半衰期就是5730年。当自然界中的生物存活时,可以通过呼吸作用与大气交换碳14,其体内碳14的含量基本不变。当生物死亡之后,这种碳素交换过程便停止了,原来体内的碳14得不到补充,而它的放射蜕变过程却依然在继续。于是从这时候开始,每隔5730年,其体内碳14的含量就减少到原来的一半,那么每隔11460年就减少到原来的四分之一……碳14年代测定法就是根据这个原理发展起来的一种推断古物或者化石年代的技术。
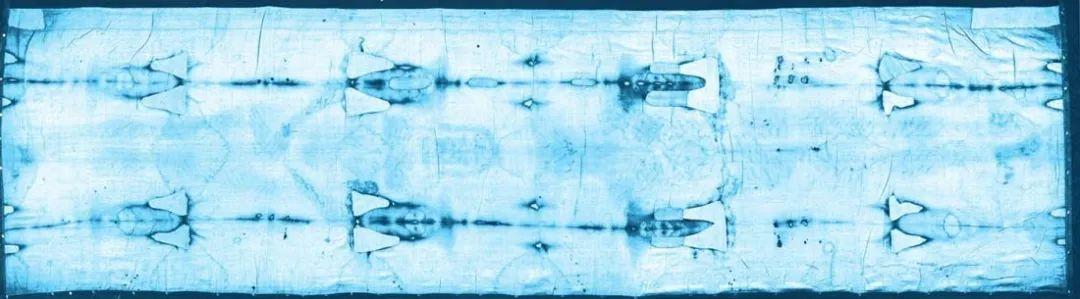
保存在意大利都灵大教堂的“耶稣裹尸布”,C14年代检测技术证明这块裹尸布是一件赝品
让我们回到刚才那块亚麻裹尸布上。在教廷的同意和监督下,一小块裹尸布被剪下并分成3份,分别交给了美国亚利桑那大学、英国牛津大学考古学研究所和瑞士苏黎世联邦理工学院的实验室,由他们分别独立地用碳14法来测定“裹尸布”的年代。最后的结果是,3个举世闻名的实验室得到的数据大致相同,制成“裹尸布”的亚麻是在公元1260—1390年之间的某个时候收割的,这个时间比耶稣钉死时(约公元30年)晚了整整1000多年!当然,这块亚麻布不可能穿越到1000多年以前去裹在被钉死在十字架的耶稣的身上,所以,这件大名鼎鼎的圣物不过是14世纪的人根据传说伪造的一件赝品。碳14为澄清历史悬案立了大功。
关于碳的学科——有机化学
你知道吗,除了石墨、金刚石等单质形式,碳还以另外一种重要的与氢原子结合的形式存在,而且已经发展成为一门学科——有机化学。
有机物分子中碳原子的数目千变万化,从一两个到成千上万,再加上不同的氢原子数目以及其他原子的加入,因此和无机物相比,有机物可以说是数目繁多,目前人类已知的有机物达上亿种,其数量远远超过无机物。

